Содержание
- Обязательная маркировка лекарственных препаратов с 2020 года
- Код маркировки лекарств: что это и для чего нужен
- Какие лекарства подлежат маркировке с 2020 года
- Этапы и сроки маркировки лекарственных средств
- Требования к маркировке лекарственных средств
- Как подключиться к системе маркировки лекарственных средств
- Что делать с немаркированными лекарствами
- Штрафы за лекарства без маркировки
Если производители не добьются обратного, с 1 января 2020 года в соответствии с Постановлением Правительства РФ № 1557 от 14.12.2018 все субъекты обращения лекарственных средств должны будут вносить в систему мониторинга сведения обо всех лекарствах. Запуск маркировки требует высокой степени готовности нормативной базы. Будущее правоприменение мониторинга лекарственных средств вызывает некоторые вопросы — так, термин «маркировка» не определен в профильном законодательстве с должной корректностью.
Между строк
Участники рынка уверенно применяют термин «маркировка» по отношению к проекту мониторинга движения лекарственных препаратов (МДЛП). Например, на сайте честныйзнак.рф написано, что «с 1 октября 2019 года маркировка станет обязательной для препаратов из перечня высокозатратных нозологий», и сам раздел называется «обязательная маркировка товаров с 2019 года».
Аналогично систему мониторинга называют маркировкой и на официальном сайте Росздравнадзора — roszdravnadzor.ru/marking, где раздел про мониторинг лекарств назван «маркировка лекарственных препаратов».
Но является ли мониторинг лекарств маркировкой с точки зрения текста закона? В ст. 46 ФЗ-61 «Об обращении лекарственных средств», которая так и называется «Маркировка лекарственных средств», подробно перечислено, что является маркировкой.
В частности, там указано, что лекарственные препараты должны поступать в обращение, если на их первичной упаковке указаны наименование препарата, номер серии, дата выпуска (для иммунобиологических препаратов), срок годности, дозировка или концентрация, объем, активность в единицах действия или количество доз; на вторичной упаковке указывается вышеперечисленное плюс наименование производителя, номер регистрационного удостоверения, способ применения, лекарственная форма, условия отпуска и хранения, предупредительные надписи. На вторичную (потребительскую) упаковку препарата наносится штриховой код.
Штриховой код, упомянутый в ст. 46, не может подразумевать двумерный Data Matrix из МДЛП. Почему законодатель не стал вносить изменения в статью о маркировке лекарств и не предусмотрел в ней ту самую «маркировку», о которой говорят все? Может быть, нужно читать между строк?
Степень смешения
Развеять сомнения поможет ст. 67 ФЗ-61, которая озаглавлена так: «Информация о лекарственных препаратах. Система мониторинга движения лекарственных препаратов для медицинского применения». В этой статье отведено отдельное место регулированию мониторинга движения лекарств и введен отдельный термин — «средства идентификации упаковок».
На любом юридическом факультете вам скажут, что при толковании закона нужно придерживаться позиции, что законодатель разумен, а значит, всегда нужно искать логическое объяснение его посылам. Тогда зачем введены два разных термина — «маркировка лекарственных средств» и «средства идентификации упаковок»?
Получается, маркировка лекарственных средств — это одно правовое явление, и регулируется оно ст. 46, а средства идентификации упаковок в ст. 67 — это совсем другое.
Кроме того, изменения, связанные с мониторингом лекарств, вносились в рамках 425-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» от 28.12.2017. Там слово «маркировка» не используется вовсе. Вместо него — «средства идентификации». Значит, двумерные коды, наносимые в рамках системы мониторинга лекарственных средств, — это средства идентификации. Если бы законодатель хотел назвать их маркировкой, он бы так и сделал.
Таким образом, законом введены два разных термина. При этом в Постановлении Правительства РФ № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» от 14.12.2018 законодатель не ориентировался и на них. Там введены понятия «лекарственные препараты, маркированные средствами идентификации», «маркировка упаковок лекарственных препаратов средствами идентификации» и т.д., то есть, понятия маркировки лекарственных средств и средств идентификации смешаны окончательно. Как сказано выше, это противоречит ст. 46 ФЗ-61 «Об обращении лекарственных средств».
Чем это грозит
Суд, установив при рассмотрении дела несоответствие нормативного правового акта иному, имеющему большую юридическую силу нормативному правовому акту, принимает судебный акт в соответствии с нормативным правовым актом, имеющим большую юридическую силу.
Получается, что в судебном споре для дезавуирования единственного нормативного акта, детально регламентирующего мониторинг лекарственных средств, — Постановления Правительства РФ № 1556 от 14.12.2018, участнику судебного процесса нужно будет просто указать на эти очевидные противоречия федеральному закону.
Если главным назначением мониторинга лекарственных средств является победа над теневым рынком лекарств, то и средства этой борьбы должны быть стопроцентными. Ведь схватка будет проходить не в виртуальной реальности, а в судебных кабинетах, в кабинетах следователей и прокуроров.
Досадная неточность
Такие неточности создают возможность для ухода от ответственности. Примеров, когда декларируемые средства правовой защиты на практике не работают или малоэффективны, множество.
Вся мебельная продукция в соответствии с Техническим регламентом Таможенного союза «О безопасности мебельной продукции» подлежит обязательной маркировке. Но достаточно дойти до ближайшего мебельного магазина, чтобы убедиться, что никакой маркировки на большинстве мебельной продукции или нет, или она не соответствует регламенту. Но уголовных дел по этому поводу вы не найдете — норма не работает и не защищает нас от некачественной и опасной мебели.
Маркировка мебели не работает, несмотря на то, что в ст. 171.1 УК РФ «Производство, приобретение, хранение, перевозка или сбыт товаров и продукции без маркировки и (или) нанесения информации, предусмотренной законодательством РФ» прямо упомянуто слово «маркировка», и этот термин полностью совпадает с термином «маркировка» в техническом регламенте, регулирующем безопасность мебели. Но для правоприменения все равно не хватило конкретики.
Что же будет с маркировкой лекарственных средств, которая в законе не совсем «маркировка», а, скорее, «средство индивидуализации»? Как это средство индивидуализации будет воспринято следователями, прокурорами, судьями? Поймут ли они, что это досадная неточность? Рискнут ли они своими карьерами, возбуждая уголовные и административные дела и изымая из оборота дорогостоящие лекарства в связи с отсутствием на них средств индивидуализации или в связи с наличием информации в системе МДЛП о том, что такие лекарства «выбыли» из оборота?
Очевидно, что маркировка лекарственных средств — это та самая маркировка. Уверен, что юридическая неточность будет исправлена и передовая система мониторинга лекарственных средств встанет на стражу нашего здоровья.
- Нормативные документы
- Сайт оператора информационной системы мониторинга движения лекарственных препаратов (маркировки лекарств) — Центр развития перспективных технологий Честный ЗНАК
- Система маркировки лекарственных препаратов на официальном сайте Росздравнадзора
- Материалы подгруппы по организации работы медицинских организаций (в том числе взаимодействия с разработчиками ПО) в ФГИС МДЛП
- Материалы всероссийской научно-практической конференции «Лекарственное обеспечение в цифровом медицинском учреждении»
- Центры компетенций
- Вопросы и ответы
Правительством Российской Федерации в числе основных направлений определена работа по модернизации процесса движения лекарственных препаратов в соответствии с лучшими международными практиками, в том числе по унификации и упрощению процедур вывода лекарств на рынок без ущерба качеству, проведению мониторинга ассортиментной политики и цен на лекарственные препараты, совершенствованию методики регистрации предельных отпускных цен производителей на жизненно необходимые лекарственные препараты, мониторингу движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя с использованием средств идентификации.
25 октября 2016 г. президиумом Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов». Краткое наименование — «Лекарства. Качество и безопасность».
Ключевые участники приоритетного проекта:
- Минздрав России;
- Росздравнадзор;
- ФНС России;
- Минпромторг России;
- Минфин России;
- Минкомсвязи России.
Субъекты обращения лекарственных препаратов:
- российские производители;
- российские и иностранные держатели регистрационных удостоверений и их представительства;
- организации оптовой и розничной торговли лекарствами;
- медицинские организации.
Цель приоритетного проекта:
- Защита населения от фальсифицированных, недоброкачественных и контрафактных лекарственных препаратов и предоставление неограниченному кругу потребителей (граждан) возможности проверки легальности зарегистрированных лекарственных препаратов, находящихся в гражданском обороте. Обеспечение прозрачности и развития справедливой конкуренции на фармацевтическом рынке.
Основными ресурсами, освещающими реализацию проекта МДЛП, являются официальные сайты Минздрава России, Росздравнадзора, Национальной системы цифровой маркировки «Честный знак». Информации в соответствующих разделах много, но в сегменте вопросов, касающихся медицинских организаций, она крайне дозированная и отвечает далеко не на все вопросы. При этом важно разобраться, что находится в силах и компетенции самой медицинской организации, и к чему придется тщательно готовиться, особенно к тем аспектам процесса лекарственного обеспечения, на которые система МДЛП влияет опосредованно, без регуляторного или технического воздействия.
Система мониторинга движения лекарственных препаратов будет внедряться с 01.07.2020 одномоментно по всей стране, вовлекая огромное число субъектов обращения лекарственных препаратов. По официальным оценкам в системе будут зарегистрированы около тысячи производителей и держателей регистрационных удостоверений на лекарственные препараты, порядка 2,5 тысяч оптовых фармацевтических организаций и 350 тысяч медицинских и аптечных организаций, не говоря о том, что эта система коснется всех без исключения конечных потребителей — пациентов, а это, без преувеличения, всё население Российской Федерации.
Эксперимент по внедрению системы маркировки лекарств в соответствии с Постановлением Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (вместе с «Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения») стартовал в начале 2017 года и закончится непосредственно перед переходом к промышленной эксплуатации в конце 2019 года. Промежуточные результаты и опыт добровольных участников эксперимента уже сегодня объективно показывают, что задачи, стоящие перед субъектами оборота лекарственных препаратов, далеко не простые и требуют серьезной подготовки, как организационной, так и финансовой.
При подготовке к внедрению системы МДЛП руководству медицинской организации необходимо самым тщательным образом подойти к оценке готовности и достаточности всех видов её ресурсов.
Человеческий ресурс
Трудоёмкость приемки товара при внедрении системы маркировки неизбежно возрастает, особенно, если мест приемки и выбытия лекарств из гражданского оборота в организации несколько. Частично решить этот вопрос можно при применении автоматизированных средств оптимизации считывания кодов с упаковок, но на рынке пока нет доступных решений, которые бы подходили для данных целей.
Места хранения
С 29.11.2019 ст. 67 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» дополняется ч. 7.1 в следующей редакции «Лекарственные препараты для медицинского применения, введенные в гражданский оборот до 1 января 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности.». Это значит, что с 1 января 2020 года поток медикаментов разделится на маркированный подтвержденный, маркированный неподтвержденный и немаркированный, что потребует увеличения площадей и мест хранения препаратов, так как совместное хранение этих групп товаров может привести к нарушению требований системы мониторинга движения.
С учетом вышеописанных возможных проблем с увеличением длительности проведения закупочных процедур необходимо пересмотреть в сторону увеличения нормативы складских запасов лекарств, которые смогут обеспечить непрерывность лечебно-диагностического процесса в случае непредвиденных обстоятельств.
Финансовый ресурс
Вышеуказанный прирост численности работников требует увеличения фонда оплаты труда. Потребуются затраты на организацию новых рабочих мест, оснащенным специальным оборудованием, оптимизацию систем хранения, увеличение объемов складских запасов, а также на закупку или развитие информационных систем. Это существенные затраты для любой организации, их надо планировать и своевременно изыскивать.
Время
Временные затраты на администрирование всех этапов движения лекарственных препаратов также вырастут, этот фактор крайне важно заложить в систему управления производственными процессами.
Одним из важнейших аспектов внедрения системы МДЛП для медицинского учреждения является необходимость перенастройки порядка взаимодействия с поставщиками лекарственных препаратов. В соответствии с п. 44 Положения о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденного Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (далее — Положение) при передаче лекарственных препаратов между субъектами обращения внесение информации в ФГИС МДЛП может происходить двумя способами:
- прямой;
- обратный.
При этом решение о выборе типа порядка предоставления сведений принимается субъектами обращения лекарственных препаратов, предоставляющими данные сведения, самостоятельно. Это решение необходимо закрепить в контракте на поставку лекарственных препаратов.
Прямой порядок
В случае выбора прямого порядка предоставления сведений субъект обращения, осуществляющий передачу лекарственных препаратов другому субъекту обращения в рамках гражданско-правовых отношений (поставщик), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты отгрузки лекарственных препаратов предоставляет об этом в ФГИС МДЛП сведения, предусмотренные пунктом 2 приложения № 6 к Положению.
При этом субъект обращения, осуществляющий приемку лекарственных препаратов от другого субъекта обращения ЛП в рамках гражданско-правовых отношений (заказчик, медицинская организация), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки лекарственных препаратов и регистрации в ФГИС МДЛП сведений об отгруженных медикаментах, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о принимаемых лекарственных препаратах, предоставляя об этом сведения в ФГИС МДЛП, предусмотренных пунктом 4 приложения № 6 к Положению (рис. 1).
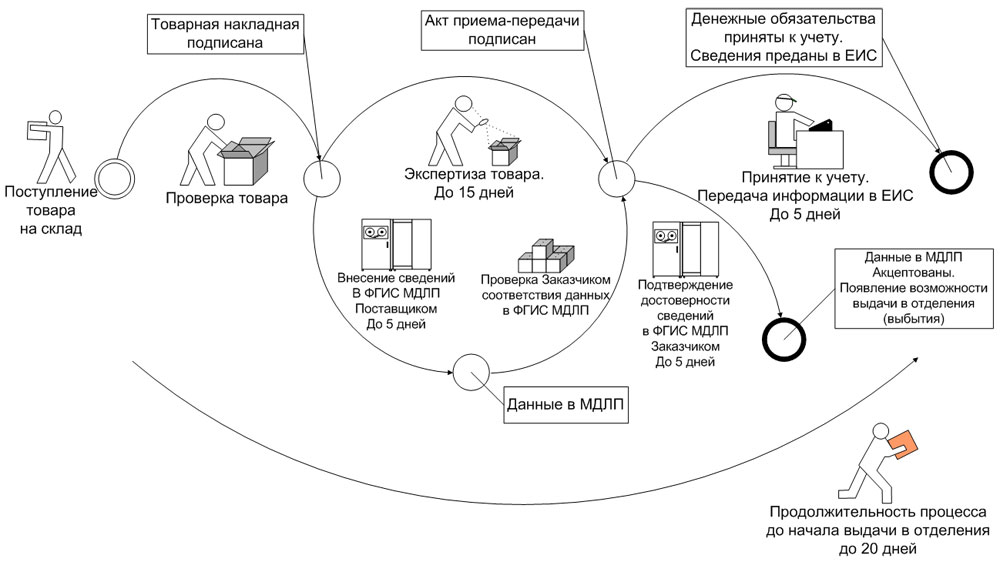
Рис. 1. Прямой способ внесения информации в ФГИС МДЛП
Обратный порядок
В случае выбора обратного порядка предоставления сведений субъект обращения, осуществляющий приемку медикамента от другого субъекта обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на ЛП, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки ЛП предоставляет в ФГИС МДЛП сведения о принятых ЛП, предусмотренные пунктом 3 приложения № 6 к Положению.
При этом субъект обращения, осуществивший передачу лекарства другому субъекту обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты регистрации в ФГИС МДЛП сведений о принятом товаре, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о переданных лекарственных препаратов, предоставляя об этом сведения в ФГИС МДЛП, предусмотренные пунктом 4 приложения № 6 к Положению (рис. 2).
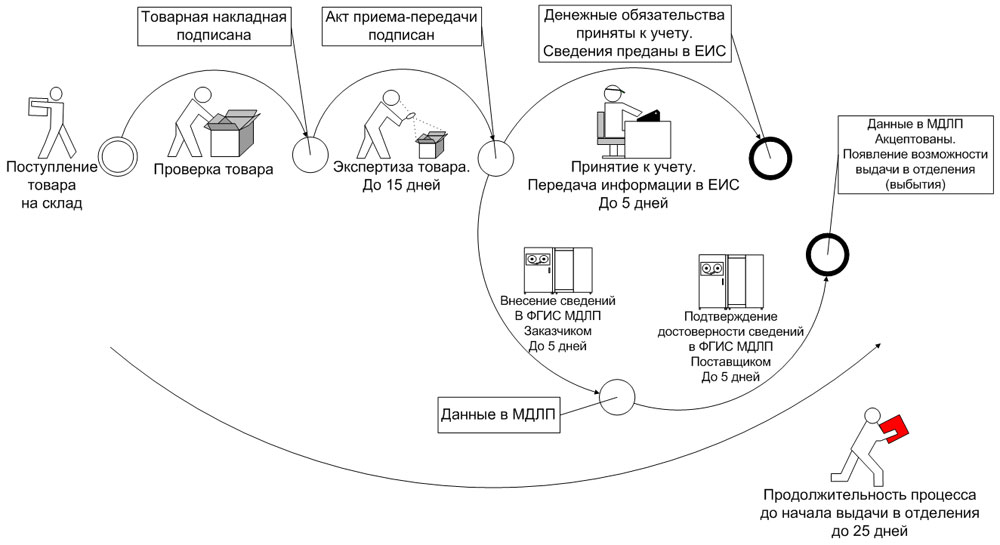
Рис. 2. Обратный способ внесения информации в ФГИС МДЛП
В ходе подготовки к работе в новых условиях системы МДЛП важно учесть особенности медицинской организации в части её системы финансирования, организационной структуры, наличию удаленных (обособленных) подразделений, организации закупок лекарственных препаратов, в том числе участие в централизованных поставках и иные аспекты деятельности, обусловливающие многочисленные внутренние и внешние взаимосвязи, необходимые для бесперебойной работы системы лекарственного снабжения, и проводить внедрение новой системы в контексте данных качественного анализа деятельности организации.
* На заседании рабочей группы Росздравнадзора было принято решение о внесении изменений в Положение, предусматривающих сокращение сроков регистрации операций в ИС МДЛП по передаче лекарственных препаратов всеми участниками до 1 рабочего дня, в целях соблюдения приоритета интересов пациента и предоставления медицинской организации возможности выполнения требований законодательства в сфере охраны здоровья, обращения лекарственных препаратов и закупок (контрактной системы) без нарушений.
Обязательная маркировка лекарственных препаратов с 2020 года
В ней задействованы участники рынка лекарственных средств (ЛС): производители, импортеры, оптовики, аптеки и медучреждения. Все они обмениваются данными с государственной информационной системой (ГИС) мониторинга «Честный знак»:
- изготовители и импортеры получают коды для новых фармизделий, и наносят марки на упаковку. Помимо этого, маркируют каждый мешок, ящик, бочку и прочую транспортную (третичную) тару с лекарствами. Сведения об этом передают в систему мониторинга;
- оптовики сообщают в «Честный знак» о том, что ЛС получены, третичная тара расформирована, медикаменты отгружены другому оптовику, в аптеку или в медучреждение;
- аптеки передают в «Честный знак» данные о приеме лекарств, о продаже потребителям или о списании;
- медицинские учреждения информируют ГИС мониторинга о получении фармпродукции, о ее внутреннем перемещении и о выбытии.
Подключиться к системе электронного документооборота для целей обязательной маркировки Подать заявку
СПРАВКА
ТПоставщик и получатель лекарств могут договориться, какой способ передачи данных в систему применять: прямой или обратный. Прямой подразумевает, что поставщик сообщает сведения, а получатель их подтверждает. При обратном способе — наоборот. Получатель передает данные, а поставщик их подтверждает.
Код маркировки лекарств: что это и для чего нужен
Уникальный двумерный штриховой код Data Matrix — это последовательность цифр и букв. Он составлен из двух кодов: идентификации и проверки.
У кода идентификации две части. Первая — международный код товара GTIN, в нем 14 символов. Вторая — индивидуальный серийный номер, в котором 13 символов.
ВАЖНО
GTIN и индивидуальный серийный номер ЛС надо дублировать в виде читаемого печатного текста. То есть на медикаменты следует наносить не только штрих-код, но и текстовый фрагмент. Отметим, что подобного требования нет ни для табачной, ни для обувной продукции.
Код проверки — это электронная подпись (ее также называют крипто-хвостом). Она складывается из ключа (4 символа) и значения кода (44 символа). При помощи данной подписи можно проверить, является ли оборот ЛС законным.
Закажите электронную подпись для работы в системах обязательной маркировки Получить через час
ВНИМАНИЕ
Data Matrix размещается на потребительской упаковке препарата. Например, на картонной коробке. Если ее нет, код наносят на первичную упаковку: блистер, ампулу и проч. Возможен и другой вариант — напечатать код на этикетке, если ее нельзя отделить от упаковки без повреждений. Плюс к этому маркировке подлежит транспортная (третичная) упаковка с фармпродукцией. На нее наносят не Data Matrix, а групповой штрих-код. Он не обязательно двумерный, допустимо сделать его линейным.
Какие лекарства подлежат маркировке с 2020 года
Для некоторых лекарственных средств обязательная маркировка началась уже в 2019 году. Речь идет о ЛС для так называемых высокозатратных нозологий (ВЗН). К ним относятся препараты для лечения:
- Гемофилии.
- Муковисцидоза.
- Гипофизарного нанизма.
- Болезни Гоше.
- Злокачественных новообразований лимфоидной, кроветворной и родственных им тканей.
- Рассеянного склероза.
- Лиц после трансплантации органов и (или) тканей.
Особенности маркировки препаратов для лечения ВЗН утверждены постановлением Правительства от 14.12.18 № 1557.
Но основная часть медикаментов подпадает под маркировку с 1 июля 2020 года. Это следует из статьи 67 Федерального закона от 12.04.10 № 61-ФЗ «Об обращении лекарственных средств» (далее — Закон № 61-ФЗ).
Нюансы прописаны в Положении о системе мониторинга движения лекарственных препаратов для медицинского применения (утв. постановлением Правительства от 14.12.18 № 1556; далее — Положение о мониторинге лекарств).
ВАЖНО
Как определить, нужно ли маркировать тот или иной медикамент? Необходимо зайти на сайт государственного реестра лекарственных средств и сделать запрос на конкретное наименование. Если данная позиция в реестре не значится, то маркировка не нужна. Такие разъяснения дает Росздравнадзор в ответах на частные обращения.
Этапы и сроки маркировки лекарственных средств
Выделяют четыре этапа внедрения маркировки.
Этап 1: с 1 июля 2019 года.
Участники оборота лекарств, предназначенных для лечения семи перечисленных выше высокозатратных нозологий, регистрируются в системе мониторинга «Честный знак».
Этап 2: с 1 октября 2019 года.
Стартует обязательная маркировка семи медикаментов для ВЗН. При этом указанные ЛС, произведенные до 31 декабря 2019 года, разрешалось хранить, перевозить, отпускать, продавать и применять без знаков идентификации до истечения срока годности. Об этом сказано в части 7.1 статьи 67 Закона № 61-ФЗ.
Этап 3: с 1 января по 29 февраля 2020 года.
У всех участников оборота лекарств (а не только у работающих с медикаментами для ВЗН) появляется обязанность по регистрации в ГИС мониторинга «Честный знак». Те, кто присоединились к обороту ЛС после 29 февраля, обязаны пройти регистрацию в течение 7 календарных дней с начала соответствующей деятельности.
Этап 4: с 1 июля 2020 года.
В общем случае маркировка становится обязательной для всех медицинских препаратов. Изготовители и импортеры при фасовке лекарств наносят на их упаковку код Data Matrix. Все участники рынка ЛС передают в систему мониторинга данные об операциях с медикаментами.
ВНИМАНИЕ
В период с 1 июля 2020 до 1 января 2021 года действуют особые правила. Их применяют к отечественным ЛС, изготовленным в июле, августе и сентябре 2020 года, а также к импортным препаратам (кроме тех, что предназначены для семи ВЗН), произведенным до 1 октября 2020 года. Такие медикаменты можно ввозить в страну и вводить в гражданский оборот без маркировки, если получить в Росздравнадзоре специальное согласование. Его выдают на срок 45 дней (постановление Правительства от 30.06.20 № 955).
Оператор системы мониторинга (это Центр развития перспективных технологий, сокращенно ЦРПТ) берет плату за предоставление кодов маркировки. Одна марка обойдется в 50 копеек без НДС. На жизненно необходимые препараты с предельной отпускной ценой производителя не более 20 руб. коды выдаются бесплатно (см. «Утвержден размер платы за оказание услуг по маркировке продукции»).
СПРАВКА
С начала обязательного этапа маркировки аптекам, которые ранее являлись плательщиками ЕНВД, приходится переходить на иные режимы налогообложения. Основание — статья 346.27 НК РФ. Из нее следует, что розничные торговцы товарами, подлежащими обязательной маркировке, не могут оставаться на «вмененке». Им необходимо сняться с учета в качестве плательщика ЕНВД, и перейти на общий режим налогообложения или УСН. Подробнее об этом см.:
— «Розничная торговля маркированными товарами: в каких случаях нельзя применять ЕНВД в 2020 году»;
— «Можно ли совмещать «розничный» ЕНВД и УСН в 2020 году?»;
— «ЕНВД и маркировка: могут ли аптеки, получившие отсрочку по маркировке лекарств, остаться на «вмененке»».
Для отказа от ЕНВД надо подать заявление по форме ЕНВД-3.
Подать заявление по форме ЕНВД‑3 через интернет и сдавать отчетность по УСН или ОСНО
Требования к маркировке лекарственных средств
Всем участникам лекарственного оборота следует пройти регистрацию в ГИС мониторинга. Для этого нужно приобрести усиленную квалифицированную электронную подпись (УКЭП). Также она необходима для подтверждения передачи данных в «Честный знак».
Аптекам потребуется ККТ с прошивкой, которая поддерживает тег для маркированной продукции. На кассе должно быть установлено программное обеспечение, способное передавать оператору фискальных данных (ОФД) чеки с кодом Data Matrix. У такого оператора должен быть модуль маркировки. Еще необходим 2D-сканер для считывания штрих-кода.
Полный комплект для онлайн-ККТ: касса по спеццене, ОФД, настройка ККТ с регистрацией в ФНС и товароучетная система со скидкой
Производителям нужно получить от ЦРПТ регистратор эмиссии кодов или подключить к нему удаленный доступ. Данное устройство позволяет получать коды для новых товарных единиц ЛС.
Отдельные правила установлены для медицинских учреждений, которые не продают лекарства, а выдают их по рецептам, либо используют для лечения пациентов. Таким организациям надо использовать специальное устройство — регистратор выбытия. Это аналог онлайн-кассы. Он передает в «Честный знак» сведения о списании медикаментов. Регистраторы выбытия предоставляются бесплатно.
Как подключиться к системе маркировки лекарственных средств
Нужно совершить следующие действия.
1. Получите сертификат усиленной квалифицированной электронной подписи (УКЭП).
Получить сертификат усиленной квалифицированной электронной подписи
2. Войдите в систему «Честный знак» и нажмите «Зарегистрируйтесь».
3. Выберите тип участника (резидент РФ или иностранный резидент), сертификат УКЭП.
4. Заполните предложенные поля, в том числе данные о лицензии на медицинскую и фармацевтическую деятельность.
5. Нажмите «Зарегистрироваться», а затем во всплывающем окне — «Подписать и отправить».
6. В течение нескольких дней ждите ответа от системы (он придет на электронную почту).
7. Получив уведомление об успешно пройденной регистрации, внесите в личный кабинет перечень адресов мест осуществления деятельности.
Подробную инструкцию по регистрации можно найти на сайте «Честного знака».
Что делать с немаркированными лекарствами
В части 7.1 статьи 67 Закона № 61-ФЗ говорится, как поступить с препаратами, произведенными до 1 июля 2020 года (в отношении лекарств для семи ВЗН — до 31 декабря 2019 года). Их можно хранить, перевозить, продавать, отпускать, передавать и применять без нанесения кодов до окончания срока годности.
Штрафы за лекарства без маркировки
Нарушители могут быть привлечены к административной ответственности по статье 15.12 КоАП РФ. В ней говорится, что контролеры вправе конфисковать товар и выписать штраф:
- за изготовление продукции без обязательной маркировки или с нарушением правил маркировки: для юрлица — от 50 тыс. до 100 тыс. руб.; для предпринимателя или должностного лица — от 5 тыс. до 10 тыс. руб.;
- за продажу, покупку с целью сбыта, хранение, транспортировку изделий без обязательной маркировки: для юрлица — от 50 тыс. до 300 тыс. руб.; для предпринимателя или должностного лица — от 5 тыс. до 10 тыс. руб.
Если указанные нарушения совершены в крупном размере, возможна уголовная ответственность по статье 171.1 УК РФ.
Учитывая немалый размер санкций, можно сделать следующий вывод. Для компаний и ИП гораздо выгоднее соблюдать правила маркировки лекарств, нежели платить большие штрафы.
Фирма «1С» проводит сертификацию программно-аппаратных комплексов на совместимость с системой программ «1С:Предприятие». Для работы с лекарственными препаратами рекомендуем приобретать у партнеров «1С» только сертифицированные модели оборудования. Для получения консультации в подключении, автоматизации, настройке и сопровождении бизнес-процессов, связанных с лекарственными препаратами, вы можете самостоятельно выбрать партнера в вашем регионе.
Нормативное правовое регулирование
Обязательность маркировки лекарств регулируется нормативными документами:
- № 1556 «Положение о системе МДЛП»;
- Постановление № 1118 от 30.08.19 о внесении изменений в Постановление № 1556;
- № 1557 «Об особенностях внедрения системы МДЛП»;
- № 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе»;
- ФЗ № 61 «Об обращении лекарственных средств»;
- № 557 «Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки».
Сроки ввода обязательной маркировки
С 01.07.2019 года началась регистрация аптек и медицинских организаций в системе Честный ЗНАК для работы с препаратами из перечня высокозатратных нозологий.
С 01.10.2019 года маркировка стала обязательной для препаратов из перечня высокозатратных нозологий.
С 01.07.2020 года маркировка станет обязательной для всех лекарств.
В соответствии с п 1.1 Постановления Правительства N1556 юридические лица и индивидуальные предприниматели, являющиеся субъектами обращения лекарственных средств в соответствии с Положением, утвержденным настоящим постановлением (далее — субъекты обращения лекарственных средств):
- осуществляют свою регистрацию в системе мониторинга движения лекарственных препаратов для медицинского применения (далее — система мониторинга) с 1 января 2020 г. до 29 февраля 2020 г. (включительно) либо после 29 февраля 2020 г. в течение 7 календарных дней со дня возникновения у субъектов обращения лекарственных средств необходимости осуществления деятельности, связанной с обращением лекарственных препаратов при наличии права осуществлять такую деятельность;
- не позднее 21 календарного дня со дня регистрации в системе мониторинга обеспечивают готовность своих информационных систем к информационному взаимодействию с системой мониторинга и направляют оператору системы мониторинга заявку на прохождение тестирования информационного взаимодействия с указанием производителей программно-аппаратных средств информационных систем.
Поддержка маркировки лекарств в решениях «1С»
Поддержка системы маркировки и прослеживания движения лекарственных препаратов в настоящий момент реализована в следующих решениях «1С»:
- «1С:Медицина. Больничная аптека»;
- «1C:Управление аптечной сетью»;
- «1С:Розница 8. Аптека»;
- «1С:Медицина. Стоматологическая клиника»;
- «1С:МДЛП» — облачное приложение для организаций с небольшим оборотом лекарств без ведения автоматизированного складского учета
Все эти продукты поддерживают работу с цифровой маркировкой лекарственных средств через «1С:Библиотеку интеграции с МДЛП».
Библиотека может быть встроена:
- в отраслевые решения на платформе «1С:Предприятия» силами партнерской сети «1С»;
- в решения на базе «1С:Предприятия» силами ИТ-службы компании.
Ознакомьтесь с некоторыми инструкциями и лекциями, которые помогут в работе с лекарствами при использовании программ «1С»:
- А. Гайдуков. Поддержка цифровой маркировки лекарственных средств в решениях фирмы «1С»: принципы реализации и подходы к автоматизации предприятий отрасли;
- Е. Семакова. Практика реализации интеграции с ИС МДЛП в облачном приложении 1С:МДЛП и программе «1С:Медицина. Больничная аптека;
- Е. Ключников. «1C:Управление аптечной сетью» и интеграция с ИС МДЛП в оптово-розничной торговле лекарственными препаратами;
- В. Андрейчак. Интеграция с ИС МДЛП в «1С:Розница 8. Аптека» при розничной реализации лекарственных препаратов.
Постановление правительства от 28 августа 2018 года N 1018 внесло изменения в постановление от 24 января, согласно которому оператором информационной системы, осуществляющим информационное обеспечение проведения эксперимента, с 1 ноября 2018 года определено ООО «Оператор-ЦРПТ» (до 1 ноября 2018 года — Федеральная налоговая служба). Федеральная государственная информационная система мониторинга движения лекарственных препаратов (ФГИС МДЛП) передана от ФНС России ООО «Оператор-ЦРПТ» без изменения функционала. Минпромторг России подготовил проект соглашения о государственно-частном партнерстве между Российской Федерацией в лице Минпромторга России и частным партнером ООО «Оператор-ЦРПТ». Таким образом, эксперимент по маркировке не перезапущен с начала, а продолжает работать с измененными условиями.
С 1 января 2018 года вступил в силу федеральный закон, вводящий обязательную маркировку всех препаратов, выпускаемых в обращение, с 1 января 2020 года. Постановлением правительства от 14 декабря 2018 года N 1557 установлены особенности внедрения системы мониторинга в отношении лекарств семи высокозатратных нозологий. В частности, начиная с 1 октября 2019 года субъекты обращения таких лекарственных средств должны будут вносить сведения о них и обо всех операциях с ними в систему мониторинга.
В рамках дальнейшего проведения эксперимента необходимо продолжить работу по тестированию с субъектами обращения лекарственных средств необходимых бизнес-процессов, в том числе на региональном уровне. На основании зарегистрированных во ФГИС МДЛП и промаркированных лекарственных препаратов будут отработаны механизмы их выбытия из оборота аптечными и медицинскими организациями через онлайн-кассы и регистраторы выбытия.
В целях реализации проекта по маркировке в рамках постоянно действующей рабочей группы, участниками которой являются представители федеральных органов исполнительной власти, оператора системы, профильных фармацевтических ассоциаций, оптовых, розничных и медицинских организаций, отечественных и зарубежных производителей лекарственных препаратов, созданы подгруппы по 15 основным направлениям эксперимента. Их работа направлена на дальнейшее развитие системы мониторинга до окончания срока эксперимента.
